Kommunikation zwischen Schadpilzen und Pflanzen

In einem von der Deutschen Forschungsgemeinschaft (DFG) geförderten Projekt untersucht Molekularbiologin Vera Göhre von der Hochschule Darmstadt (h_da), wie Schadpilze mit ihren Wirtspflanzen kommunizieren. Im konkreten Fall geht es um Pilze, die Kulturpflanzen wie Mais, Kohl, Rüben, Reis oder Raps befallen. Göhre und ihr Team möchten herausfinden, wie genau es ihnen gelingt, in ihre „Gastgeber“ einzudringen und sie umzuprogrammieren. Dabei sind trickreiche Kommunikationskanäle im Spiel, die die Wissenschaft erst allmählich zu verstehen beginnt. Die Erkenntnisse könnten einen wichtigen Beitrag zur Welternährung leisten: Weltweit sind mehrere hundert Pilzerkrankungen bekannt, die nach Schätzungen der Max-Planck-Gesellschaft jährlich zu Ernteausfällen von zwanzig bis vierzig Prozent führen. Eine Entwicklung, die durch den Klimawandel und zunehmende Resistenzen verstärkt wird.
Von Christina Janssen, 13.12.2024
Unkraut zu jäten, gehört nicht unbedingt zum Aufgabengebiet einer Professorin. Oder ist das an der h_da etwa anders? Jedenfalls war es eine von Vera Göhres ersten Aktionen, als sie im Frühjahr ihre Professur in Darmstadt antrat, einen Waschbetonkübel auf dem Campusparkplatz zu kapern und dort kleine Gänsekresse-Setzlinge einzupflanzen. Die Kreuzblütler werden seitdem gehegt und gepflegt – und in Lehrveranstaltungen vorgezeigt. Der Clou: Einige der Pflanzen sind mit dem Brandpilz Thecaphora thlaspeos infiziert, andere nicht. In der Vorlesung präsentiert die Molekularbiologin ihren Studierenden die grau-grünen Büschelchen. „Aber es gelingt niemandem, infizierte und nicht-infizierte Pflanzen zu unterscheiden“, berichtet die Wissenschaftlerin. Was nicht etwa an der Inkompetenz der Studierenden liegt, sondern am listigen Pilz, der sich erst spät zu erkennen gibt – wenn das Pflänzchen bereits Saatgut bildet.
Gerissen wie Odysseus
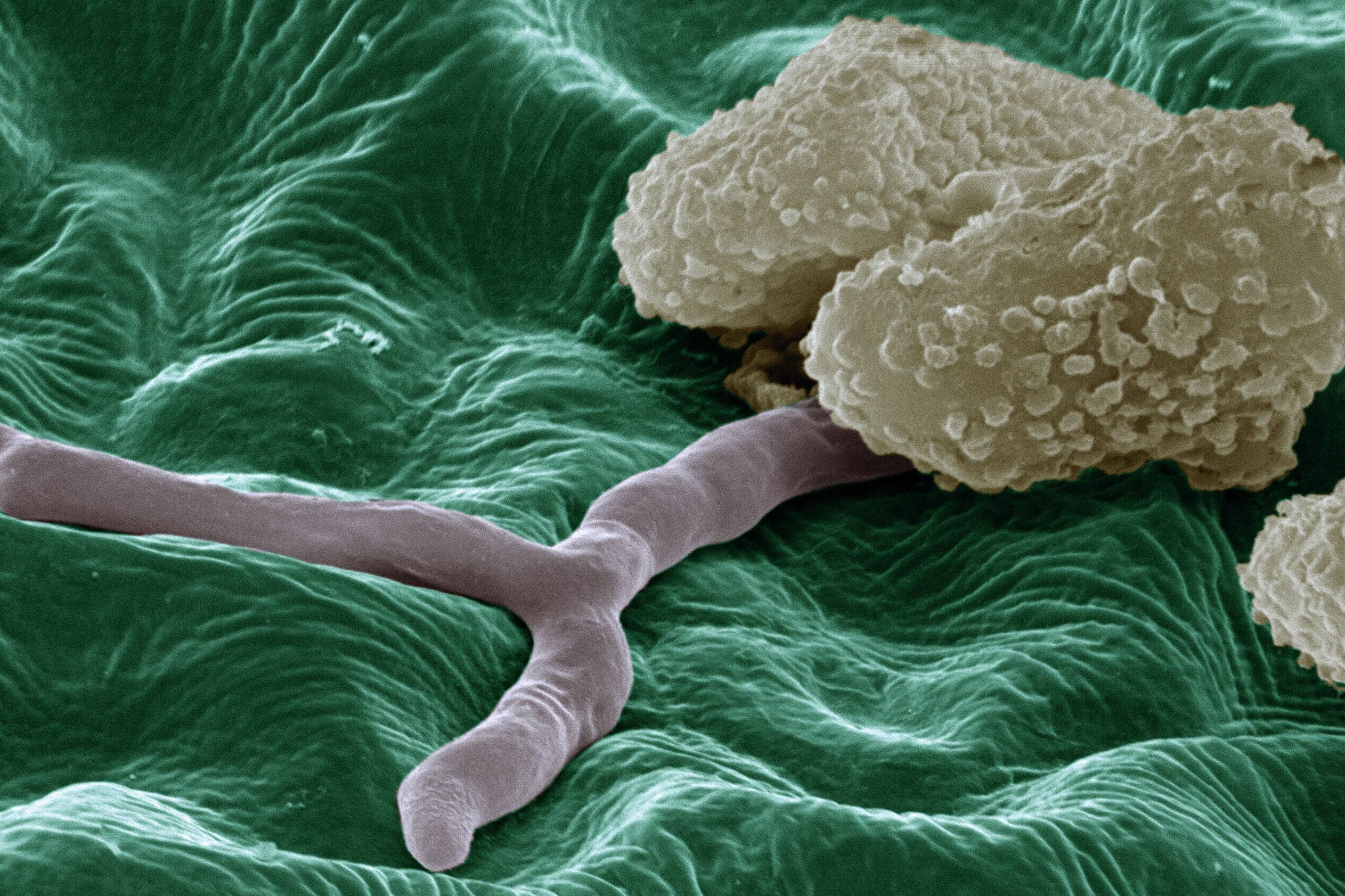
Odysseus und sein trojanisches Pferd wirken geradezu blass gegen die Raffinesse, mit der der Pilz vorgeht. Schritt 1: Die PiIzspore landet auf ihrer Wirtspflanze und „erkennt“ die potenzielle Beute. Schritt 2: Die Spore keimt aus. In Schritt 3 wird es tricky: Der Pilz muss irgendwie in die Pflanze hinein. Wegen der festen Zellwand ist das ausgesprochen schwierig. Hat der Pilz dies geschafft, folgt Schritt 4: Der Pilz schleust kleine „Sabotage-Moleküle“ in die Pflanzenzelle ein – und damit ist der Point of no Return erreicht: Im Innern programmiert der Pilz die Pflanzenzelle um. Ab sofort produziert die Zelle eifrig Nährstoffe für den Schmarotzer. Wie genau das alles vonstattengeht, gibt der Fachwelt noch viele Rätsel auf.
„Wie ernähren sich Pilze in der Pflanze? Wie modifizieren die Pilze eine Pflanze zu ihrem eigenen Vorteil? Und wie reagiert die Pflanze darauf?“, beschreibt Vera Göhre die zentralen Fragen ihrer Forschung. Wer es herausfindet, kann den Pilzbefall eines Tages ohne den Einsatz giftiger Fungizide verhindern. So die Hoffnung. Im April hat Göhre die Professur für Molekulare Biotechnologie und funktionelle Genomik an der h_da angetreten. Zuvor forschte die Molekularbiologin zwölf Jahre lang an der Heinrich-Heine-Universität Düsseldorf als Gruppenleiterin im Exzellenzcluster für Pflanzenwissenschaften (CEPLAS). Im DFG-Projekt, das Göhre von dort mitgebracht hat, möchte die Forscherin der vertrackten Beziehung zwischen Schadpilzen und Pflanzen auf den Grund gehen.
Parship mit Pilzen
Begonnen hat alles mit einem „Date“ – zwischen der Forscherin und dem perfekten Pilz: In einem witzigen Artikel für das CEPLAS-Forschungscluster beschreibt die Wissenschaftlerin ihre Suche nach dem optimalen Forschungsobjekt als eine Art Pilz-Parship. Dabei machte der Brandpilz Thecaphora thlaspeos das Rennen. Einiges haben Göhre und ihr Team seitdem schon über ihn herausgefunden, allerdings nicht beim Candlelight-Dinner, sondern im Labor. Einer der großen Rätselpunkte ist Schritt 3: Wie gelangt der Pilz in die Pflanze? „In der Zellwand gibt es keine Türen“, bringt es die Forscherin auf den Punkt und klopft an ihre weiß gestrichene Bürowand. „Wenn ich meinen Kollegen im Nachbarbüro besuchen will, gehe ich durch meine Tür raus und durch seine Tür rein. Wenn ich aber ein Pilz bin und die Wand hier eine Pflanzenzelle, muss ich ein Loch in diese Wand bohren. Und genau das tun die Pilze auch.“
Dafür greifen die schlauen Schädlinge in die molekularbiologische Trickkiste: „Sie können zum Beispiel Enzyme absondern, die die Zellwand `wegfresssen‘“. Darunter stößt der Pilz dann auf die Zellmembran. Und die kann die Pflanze einige Stoffe herausschleusen. Zum Beispiel für Zuckermoleküle, die die Pflanze bei der Photosynthese in ihren Zellen herstellt. „Die gibt die Pflanzenzelle freiwillig nach außen ab, in der ‚Annahme‘, dass sie in die Wurzeln oder Blüten transportiert werden. Wenn sich da aber gerade der Pilz niedergelassen hat, kann er den Zucker einfach abfischen.
Bahnbrechende Erkenntnisse
Doch damit gibt sich der Schädling nicht zufrieden: Zusätzlich schleust der Pilz eigene Proteine und genetische Informationen durch die Membran in die Pflanzenzellen. „Der neue wissenschaftliche Ansatz besteht darin, diesen ‚Hautkontakt‘ zwischen Pilz und Pflanze zu untersuchen. Also herauszufinden, was passiert, wenn Pilzmembran und Zellmembran aufeinanderstoßen“, berichtet Göhre. „Aus der Medizin ist bekannt, dass Krankheitserreger gezielt bestimmte Moleküle in kleine Bläschen, verpacken, in sogenannte Vesikel.“ In solchen Bläschen schleusen nach aktuellem Forschungsstand auch Pilze ihre „Werkzeuge“ in Pflanzenzellen ein. Eine bahnbrechende Erkenntnis. „Bis vor drei, vier Jahren wurde dogmatisch gesagt: Das geht nicht, durch die starre Pflanzenzellwand kommt nichts rein oder raus.“ Inzwischen herrscht die Meinung vor, dass es die „trojanischen“ Vesikel tatsächlich gibt. „Im Rahmen der Forschergruppe exRNA sind wir mit den Düsseldorfer Kollegen gerade dabei, für den Maisbeulenbrand schlüssig zu beweisen, dass in diesen Bläschen immer wieder dasselbe drin ist und in der Pflanzenzelle eine Funktion hat.“ RNA und Proteine zum Beispiel, mit denen der Pilz das Immunsystem der Pflanze ausschaltet und im Zellkern, der Schaltzentrale der Zelle, die Kontrolle übernimmt.
Und die Pflanzen? Versuchen durchaus, sich zu wehren. Auch sie können kleine Bläschen mit RNA-Schnipseln aussenden. Eine Vesikel-Schlacht entbrennt zwischen Pilz und Pflanze. Und genau hier will die Forschung ansetzen: „Wenn wir die RNAs identifizieren können, die die Pflanze zu ihrer Verteidigung rüberschickt, können wir sie für den Pflanzenschutz nutzen. Entweder indem wir die Pflanzen für die Forschung genetisch so verändern, dass sie aus eigener Kraft mehr davon produzieren. Oder indem man RNA-Sprays für den Pflanzenschutz entwickelt.“ Spray induced gene silencing nennt sich das, also das Ausschalten von Genen (im Schadpilz) über ein RNA-Spray. Die ersten Start-ups in diesem Bereich haben sich schon gegründet, berichtet Göhre. Der massenhafte Einsatz von Fungiziden könnte durch solche Technologien obsolet werden.
Viele offene Fragen
Doch der Weg dahin ist weit. „Es gibt noch so viele offene Fragen – mehr als ich in meiner ganzen Professur werde beantworten können“, sagt die Forscherin. „Nur ein Beispiel: Woher wissen die Vesikel, wo sie hin müssen? Ich stelle mir das vor wie ein Bällebad mit roten und blauen Bällen – die roten müssen vom Pilz zur Pflanze, die blauen umgekehrt. Totales Chaos. Wie funktioniert das? Das würde ich gerne herausfinden.“ Ein Konsortium mit mehr als zehn Arbeitsgruppen sucht gemeinsam nach Antworten: Woher weiß ein Pilz, was er in seine Vesikel laden muss? Wo genau passiert das? Woher weiß ein Protein oder eine RNA: Ich soll in das Vesikel oder eben nicht, welche Signale gibt es dafür? „Unsere Forschung steckt noch in den Kinderschuhen“, resümiert Vera Göhre.
Thecaphora thlaspeos hat sich die Wissenschaftlerin, die vor ihrem Wechsel an die h_da berufliche Stationen in Frankreich, den USA, Australien, England und der Schweiz hatte, ausgesucht, weil er genetisch sehr einfach gestrickt ist. Wie auch die Gänsekresse, die er befällt. Ein „Traumpaar“ für die Forschung. „Jeder Pilz hat seine Pflanze und jede Pflanze teilweise sogar mehrere Pilze.“ Deshalb zielt Göhres Projekt auf übertragbare Ergebnisse ab, die sich auch auf wirtschaftlich relevante Pilze wie den Maisbeulenbrand, Getreidebrände oder Schimmelpilze anwenden lassen. Übergeordnetes Ziel: ein besserer Pflanzenschutz und höhere Erträge – ohne den Einsatz von Gift. Oder aber man macht aus der Not auch eine Tugend: „In Mexiko“, berichtet die Wissenschaftlerin, „werden die vom Maisbeulenbrand infizierten Kolben als Delikatesse zubereitet.“ Und den Reisbrand, der in China in Wasserreis seit 2000 Jahren als „Wasserbambus“ kultiviert wird, findet die weitgereiste Forscherin absolut schmackhaft. „Wie eine Mischung aus Champignon und Bambus – superlecker. Vielleicht das Superfood der Zukunft?“ Ganz ernst gemeint ist der Vorschlag nicht, aber wer sein Forschungsprojekt mit einem Pilz-Date beginnt, hat ganz offensichtlich nicht nur Spürsinn im Labor, sondern auch Sinn für Humor.
Kontakt zur h_da-Wissenschaftsredaktion
Christina Janssen
Wissenschaftsredakteurin
Hochschulkommunikation
Tel.: +49.6151.533-60112
E-Mail: christina.janssen@h-da.de
Studiengänge am Fachbereich "CuB"
Quellen
Max-Planck-Gesellschaft, 10.10.2024:
Fakten zum Einfluss von Pilzbefall auf die Ernährungssicherheit